Sélection de résultats scientifiques : Identification et caractérisation de complexes associés à CTIP2 comme régulateurs clés dans l’établissement de la persistance de VIH-1 dans les réservoirs infectés de manière latente
Contribution à l’établissement de réservoirs de VIH-1 infectés de façon latente – Le Douce et al., Nucleic Acids Res. 2012
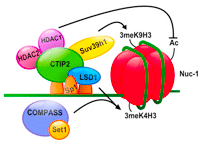
Les cellules microgliales sont les cibles majoritaires de VIH-1 dans le système nerveux central (SNC) et constituent un important réservoir de cellules infectées de manière latente. L’établissement et la persistence de ces réservoirs repose sur la structure de la chromatine et des provirus intégrés. Nous avons précédemment démontré que le cofacteur cellulaire CTIP2 force la formation de l’hétérochromatine et le silencing du gène du VIH-1 par recrutement des activités de HDAC et HMT au niveau du promoteur viral intégré. Dans cet article, nous avons reporté que l’histone déméthylase LSD1 réprime la transcription de VIH-1 et l’expression virale de manière synergique avec CTIP2. Nous avons montré que le recrutement de LSD1 au promoteur proximal de VIH-1 est associé avec les marques génétiques H3K4me3 et H3K9me3. Enfin, nos données suggèrent que la trimethylation de H3K4 induite par LSD-1 est liée au recrutement de hSET1 au niveau du provirus intégré.
Contribution à la persistance de réservoirs – Cherrier et al., PNAS 2013
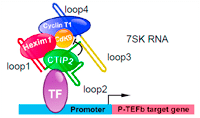
La transcription positive du facteur d’élongation b (P-TEFb) est impliquée dans des évènements physiologiques et pathologiques y compris l’inflammation, le cancer, le SIDA et l’hypertrophie cardiaque. La balance entre ses formes active et inactive est sévèrement contrôlée pour assurer l’intégrité cellulaire. Recruté par le transactivateur Tat de VIH-1, P-TEFb est un facteur clé cellulaire nécessaire pour activer la transcription du gène VIH-1. Nous avons rapporté que le répresseur transcriptionnel CTIP2 est un modulateur majeur de l’activité de P-TEFb. CTIP2 co-purifie et interagit avec un complexe inactif de P-TEFb contenant 7SK snRNA et HEXIM1. CTIP2 s’associe directement avec HEXIM1 et, via la boucle 2 et le 7SK snRNA avec P-TEFb. Dans ce complexe nucléoprotéique, CTIP2 réprime significativement l’activité kinase Cdk9 de P-TEFb. En accord avec cela, nous montrons que CTIP2 inhibe un large lot de gènes sensibles à P-TEFB et 7SK snRNA. Dans les cœurs de souris qui ont des hypertrophies cardiomyopathiques, CTIP2 contrôle les voies sensibles à P-TEFb impliquées dans l’établissement de cette pathologie. Pris ensemble, nos résultats suggèrent que CTIP2 contrôle les fonctions de P-TEFb dans des conditions physiologiques et pathologiques incluant l’infection à VIH-1.
(Contribution à la persistence des résevoirs) – Eilebrecht et al., Nucleic acids Res. 2014

Comme déterminé ci-dessus, la transcription active positive du facteur d’élongation b (P-TEFb) est essentielle pour la transcription de l’élongation du virus l’immunodéficience humaine et cellulaire de type 1 (HIV-1). CTIP2 réprime l’activité de P-TEFb dans un complexe contenant 7SK RNA et HEXIM1. Le court RNP nucléaire (snRNP) inactif 7SK/P-TEFb a été détecté au cœur du promoteur pour VIH-1 ainsi qu’au niveau des gènes des promoteurs cellulaires, mais le mécanisme de recrutement reste toujours inconnu à cette date. Dans cet aricle, nous avons montré les synergies globales entre CTIP2 et les 7SK liés à la chromatine qui sont maîtres de régulation HMGA1 en termes de P-TEFb endogènes dépendants et de régulation de l’expression des gènes VIH-1. En plus, les expériences d’immunoprécipitation de la chromatine révèle une perte significative de recrutement de CTIP2/7SK/P-TEFb snRNP aux promoteurs de gènes cellulaires et le promoteur de VIH-1 sur le knock-down HMGA1. Nos trouvailles ne font pas qu’apporter des connaissances sur les mécanismes de recrutement pour les 7SK/P-TEFb snRNP inactifs, mais contribuent aussi à une meilleure compréhension de la latence virale.
L’étude de la preuve de concept démontre l’efficacité des stratégies de réactivation pour réduire les réservoirs (collaboration avec le laboratoire de Carine Van Lint, ULB, Belgique)
Bouchat et al., AIDS 2012
La réactivation de l’expression de VIH-1 dans les réservoirs persistents avec un HAART efficace a été proposée comme thérapie adjuvante ciblée sur la recherche d’un remède fonctionnel pour VIH-1. Précédemment, la méthylation de H3K9 s’est avérée jouer un rôle dans la répression médiée par la chromatine dans le promoteur du VIH-1. Dans cet article, nous avons évalué le potentiel thérapeutique des inhibiteurs d’histrone méthyltransférase (HMTIs) dans la réactivation de VIH-1 à partir de la latence.
Nous avons démontré, pour la première fois, que la chaetocin (inhibiteur de SUV39H1) induit la guérison de VIH-1 dans 50% des cultures de CD8 déplétés en PBMC et dans 86% des cultures de cellules T CD4 au repos isolées de cellules infectées par VIH-1 chez les patients traités à la HAART, en revanche les cellules réactivées avec BIX-01294 (inhibiteur de G9A) présentent une réactivation du VIH-1 de 80% des cultures de cellules T CD4 au repos isolées de patients similaires. De plus, nous avons montré que les traitements combinatoires incluant une HMT1 et soit un acide suberoylanilide hydroxamic inhibiteur d’histone déacétylase ou le non-promoteur tumoral NF-κB induisant la prostatine a eu un plus haut potentiel de réactivation que ces composants seuls. Nos résultats constituent une preuve de concept pour le potentiel thérapeutique des HMTIs dans les statégies ciblant la réduction du pool de réservoirs latents chez les patients infectés par le VIH traités par HAART.
Darcis et al., PLoS Path 2015
La persistance de cellules infectées de manière latente chez les patiens sous thérapie antirétrovirale combinatoire (cART) est un obstacle majeur à l’éradication de VIH-1. Les stratégies pour purger ces réservoirs sont nécessaires à l’activation de l’expression de gène viral dans les cellules infectées de manière latente est une statégie prometteuse. Les bromodomaines et inhibiteurs de bromodomaines extraterminal sont des composants capables de réactiver les provirus latents dans un facteur positif d’élongation de la transcription b (P-TEFb) de manière dépendante. Dans cette étude, nous avons testé le potentiel de réactivation d’agonistes de la protéine kinase C (PKC) (prostratin, bryostatin-1 and ingenol-B), qui sont connus pour activer la voix de signalisation de NF-κB ainsi que P-TEFb, utilisé seul ou une combinaison d’agents de relargage de P-TEFb (HMBA et BETi (JQ1, I-BET, I-BET151)). En utilisant des lignées cellulaires modèles d’intégration post-latence de VIH-1 et des lignées myéloïdes, nous avons démontré que les agonistes de PKC et les agents de relargage de P-TEFb seuls ont agi comme des agents de réversion de la latence (LRAs) et que leurs combinaisons ont mené à l’activation synergique des niveaux d’expression de l’ARNm viral et des protéines. Mécaniquement, les traitements combinés ont mené à de plus fortes activations de P-TEFb et NF-κB que les traitements correspondants individuels. De manière importante, nous avons observé dans des cultures ex vivo de CD8+ déplétés en PBMC de 35 patients avirémiques VIH-1 traités au cART que le pourcentage de cultures réactivées suivant un traitement combiné de bryistatin-1+JQ1 était identique au pourcentage observé avec une stimulation de contrôle positif des anticorps anti-CD3+ anti-CD28. Remarquablement, les cultures au repos de cellules T CD4+ isolées de patients avirémiques traités avec 15 HIV-1 + cART les combinaisons bryostatin-1+JQ1 ont relargué des virus infectieux à des niveaux similaires à ceux obtenus avec une simulation contrôle positif. Les effets puissants de ces deux combinaisons de traitements étaient déjà détectés à 24h post-stiumulation. Ces résultats constituent la première démonstration de combinaisons de LRA exhibant un tel effet puissant et représentant une preuve de concept pour la co-administration de deux types différents de LRA comme une stratégie potentielle pour réduire la taille des réservoirs latents de VIH-1.
Bouchat et al., EMBO Mol Med 2015
La réactivation de l’expression de VIH dans les cellules infectées de manière latente avec un cART efficace a été proposée comme thérapie adjuvante visant à éliminer/réduire la taille des réservoirs. Les résultats d’essais cliniques VIH utilisant les inhibiteurs de deacetylase (HDACIs) remettent en question l’efficacité de ces agents de réversion de la latence (LRAs) utilisés seuls et soulignent le besoin d’évaluer d’autres LRAs en combinaison avec des HDCAIs. Nous avons évalué le potentiel thérapeutique de l’agent déméthylant (5-AzadC) en combinaison avec des HDCAIs cliniquement tolérables pour réactiver VIH-1 depuis la latence, d’abord in vitro puis ex vivo.
Nous avons montré qu’un traitement séquentiel avec 5-AzadC et des HDACIs était plus efficace que les deux traitements correspondants simultanés à la fois in vitro et ex vivo. De manière intéressante, seuls deux des combinaisons de séquences de traitements de LRA testés ont induit une récupération des particules de VIH-1 de manière plus forte que les traitements seuls ex vivo et à des concentrations plus faibles que les concentrations plasmatiques tolérables humaines. Pris ensemble, nos données révèlent le bénéfice d’utiliser des combinaisons de 5-AzadC avec un HDACI et, pour la première fois l’importance de la planification temporelle du traitement pour les combinaisons de LRA dans le but de réactiver le VIH.

Forouzanfar et al., Sci Rep. 2019
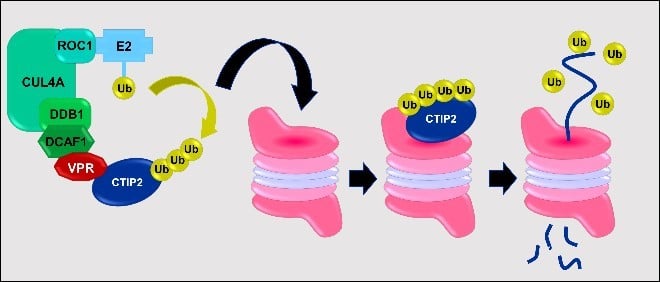
Les mammifères ont obtenu de nombreux facteurs antiviraux impactant les différentes étapes du cycle de vie viral, grâce à l’évolution. Associés avec des enzymes modifiant la chromatine, le cofacteur cellulaire CTIP2 contribue au silencing du gène VIH-1 dans les réservoirs infectés de manière latente qui constituent le blocage majeur envers un remède au VIH. Nous rapportons, pour la première fois, que le virus a développé une stratégie pour surmonter ce blocage transcriptionnel majeur. L’infection productive du VIH-1 a pour résultats une déplétion médiée par Vpr de CTIP2 dans des cellules microgliales et cellules T CD4+, deux réservoirs viraux majeurs.
Associé au complexe ligase ubiquitine Cul4A-DDB1-DCAF1, Vpr promeut la dégradation de CTIP2 via la voix métabolique du protéasome dans le noyau des cellules cibles et notamment dans le promoteur latent HIV-1. De manière importante, Vpr cible CTIP2 associé avec des enzymes promotrices de l’hétérochromatine dédiées au silencing du gène VIH-1. De ce fait, Vpr réactive l’expression de VIH-1 dans le modèle microglial de la latence de VIH-1. En somme, nos résultats suggèrent que le Vpr VIH-1 médie la déplétion du répresseur cellulaire CTIP2 pour contrecarrer le silencing du gène.
Ait-Ammar et al. Sci Rep. 2021
La latence de VIH-1 génère des réservoirs qui préviennent l’éradication virale par les thérapies actuelles. Pour trouver des stratégies vers un traitement pour le VIH, une compréhension détaillée des mécanismes moléculaires sous-jacents de l’établissement et de la persistence des réservoirs est nécessaire. Le facteur cellulaire de transcription KAP1 est connu comme un puissant répresseur de la transcription de gènes. Ici, nous rapportons que KAP1 réprime l’expression génique de VIH-1 dans les cellules myéloïdes incluant les cellules microgliales, le résevoir majeur du système nerveux central. Mécaniquement, KAP1 interagit et colocalise avec le transactivateur viral Tat pour promouvoir sa dégradation via la voix métabolique du protéasome et réprime l’expression génique de VIH-1. Dans les modèles myéloïdes de l’infection VIH-1 latente, la déplétion de KAP1 a augmenté l’élongation et la réactivation de l’expression des gènes viraux de VIH-1. Lié au promoteur latent de VIH-1, KAP1 s’associe et coopère avec CTIP2, un silencer épigénétique clé de l’expression de VIH-1 dans les cellules microgliales. De plus, Tat et CTIP2 sont en compétition pour se lier à KAP1, suggérant, une modulation dynamique des partenaires cellulaires de KAP1 lors de l’infection au VIH-1. En somme, nos résultats suggèrent que KAP1 contribue à l’établissement et à la persistence de la latence de VIH-1 dans les cellules myéloïdes.
 Intranet
Intranet Acces
Acces Contact
Contact
