Sécurité et biodégradabilité des nanomatériaux de carbone et 2D
Il a été rapporté que le comportement des NTC non-fonctionnalisés était très similaire à celui des fibres d’amiante, ouvrant le débat sur le développement et l’utilisation de ces matériaux susceptibles de provoquer l’apparition d’un mésothéliome. Cependant, nous avons démontré qu’une fonctionnalisation chimique appropriée des NTC atténue les effets pathogènes et le profil de réactivité des NTC longs et non-fonctionnalisés à parois multiples, ce qui les rend plus sûrs à utiliser (1). Nous avons également découvert comment la quantité de groupements fonctionnels détermine la distribution tissulaire et l’élimination des NTC. En effet, à mesure que le nombre de groupes fonctionnels liés de manière covalente aux NTC augmente, le profil d’excrétion des NTC fonctionnalisés augmente également, tandis que l’accumulation dans les différents organes est modulée (2). Les différentes études sur le comportement in vivo des NTC ont été complétées par des expériences cellulaires in vitro visant à mieux clarifier les mécanismes d’internalisation cellulaire, de trafic intracellulaire et d’exocytose des NTC (3). Une partie de notre activité est également dédiée à l’étude de l’impact des NTC sur les cellules immunitaires. Des NTC fonctionnalisés ont été testés sur des lymphocytes T et B humains, des cellules tueuses naturelles (NK) et des monocytes, montrant que la viabilité de ces cellules n’est pas affectée bien qu’une forte activation ait été mise en évidence sur les monocytes et les cellules NK, suggérant une utilisation possible de ces nanotubes comme systèmes immunomodulateurs. (4).
Sur la base de notre expérience approfondie des NTC, nous avons étendu nos études aux matériaux à base de graphène (5). Ceci fait partie du grand projet européen appelé Graphene Flagship dans lequel notre équipe est impliquée pour évaluer l’impact du graphène et d’autres matériaux 2D sur les cellules immunitaires. Nous avons découvert un comportement intéressant de l’oxyde de graphène que nous avons appelé effet masque (6). Les travaux ont ensuite été étendus aux cellules immunitaires périphériques humaines de donneurs sains. L’exposition à de petits feuillets d’oxyde de graphène s’est avérée avoir un impact plus significatif sur les cellules immunitaires par rapport aux grands feuillets (7). En parallèle, nous avons rapporté la distribution tissulaire de l’oxyde de graphène fonctionnalisé marqué à l’indium radioactif après administration intraveineuse chez la souris (8). Des feuillets intacts ont été détectés dans l’urine des souris injectées. Ces résultats offrent une compréhension pharmacologique de la manière dont l’oxyde de graphène fonctionnalisé se transporte dans la circulation sanguine et interagit avec les barrières physiologiques qui déterminent son élimination corporelle et son accumulation tissulaire. De plus, nous avons étudié si une filtration glomérulaire extensive de feuillets d’oxyde de graphène pouvait provoquer des lésions rénales (8). Plus récemment, nous avons étudié l’impact de l’oxyde de graphène fonctionnalisé à l’aide de la cytométrie de masse unicellulaire, une technique puissante qui permet d’analyser plusieurs populations de cellules immunitaires, et d’interroger plusieurs marqueurs en même temps (9). Nous étendons maintenant nos études à d’autres matériaux 2D, comme les dichalcogénures de métaux de transition (par exemple, MoS2). Nous avons comparé l’effet du graphène constitué de quelques feuillets (FLG) et du MoS2 sur l’activation cellulaire et les processus intracellulaires comme l’autophagie. Nous avons examiné les macrophages dérivés de monocytes humains M1 et M2 et avons trouvé une toxicité minimale en termes de viabilité cellulaire et d’activation avec la sécrétion de cytokines inflammatoires par MoS2, tandis que le FLG avait un impact minimal sur l’autophagie sécrétant des gènes spécifiques liés à l’autophagie (10). Les études in vitro ont été complétées par l’injection de FLG in vivo (11). Nous avons étudié la distribution tissulaire et les effets toxiques du graphène chez la souris jusqu’à 30 jours après l’injection intraveineuse. L’analyse histologique des tissus a révélé une accumulation hépatique et une excrétion par les reins. Les paramètres biochimiques et hématologiques sont restés dans la plage de référence ne montrant aucune hématotoxicité, et aucun signe d’inflammation n’a été détecté dans les cellules isolées des ganglions lymphatiques et de la rate.
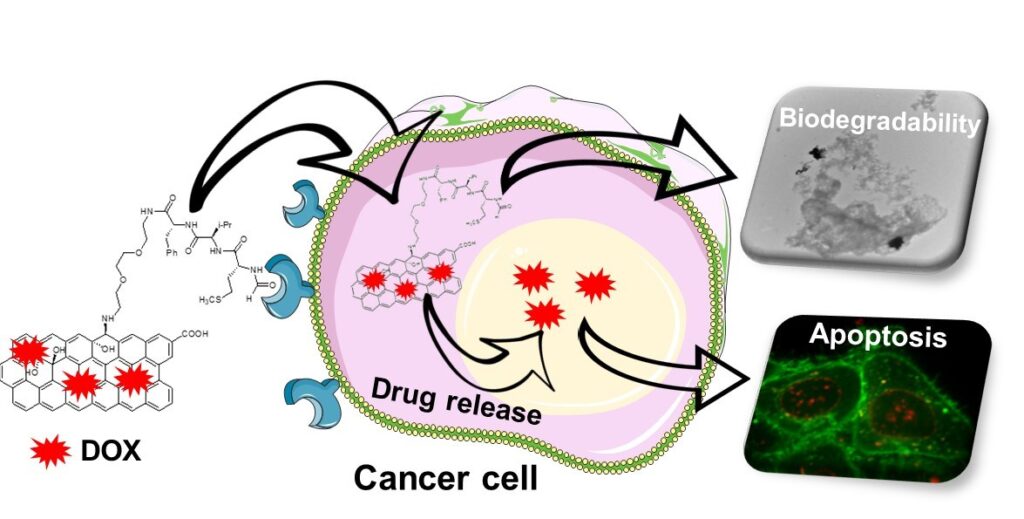
Un aspect fondamental associé au développement de nanomatériaux pour la thérapie et le diagnostic concerne leur profil de biodégradabilité et leur biopersistance. Les NTC ont été considérés comme biopersistants pendant de nombreuses années, jusqu’à la découverte que certaines peroxydases sont capables de dégrader des NTC oxydés à simple paroi. Cela a donné un nouvel espoir de développer les NTC comme vecteurs de médicaments. Nous avons découvert que les NTC multi-parois oxydés peuvent également être dégradés par les peroxydases dans des tubes à essai (12). Les NTC multi-parois fonctionnalisés peuvent également être dégradés in vitro dans les macrophages. Nous avons observé par microscopie électronique à transmission la dégradation in situ des CNT médiée par des espèces réactives de l’oxygène. Deux mécanismes de dégradation déclenchés par des radicaux hydroxyles ont été mis en évidence: un processus d’amincissement des parois non spécifique au site et un processus de forage transversal spécifique au site sur les défauts préexistants des nanotubes (13). Nous avons récemment introduit un nouveau concept, la dégradation par conception, pour rendre les nanotubes plus sûrs en fonction de leur modification de surface avec des substrats fonctionnels capables d’améliorer l’activité de dégradation enzymatique des peroxydases (14). Nous étendons actuellement les études de biogégradabilité au graphène et aux matériaux 2D (15). Nous avons démontré que l’oxyde de graphène peut être dégradé par les peroxydases, et que sa dégradation dépend fortement de la dispersabilité dans l’eau (16). Nous avons découvert que la myéloperoxydase sécrétée par les macrophages activés est capable de dégrader le graphène constitué de une ou plusieurs couches (17). Un comportement similaire se produit avec le nitrure de bore hexagonal et des nanofeuillets de MoS2 (18). Nous avons ensuite étendu le concept de dégradation par conception aux matériaux à base de graphène (19). Nous avons constaté qu’une fonctionnalisation covalente appropriée avec des ligands capables d’activer des enzymes oxydantes améliore la biodégradation de l’oxyde de graphène. Sur la base de cette approche, nous avons récemment modifié l’oxyde de graphène avec un peptide capable de reconnaître les récepteurs surexprimés dans les cellules cancéreuses et de déclencher l’activation des neutrophiles (20). Cette plate-forme à biodégradabilité améliorée a été utilisée pour fournir de la doxorubicine aux cellules cancéreuses et induire l’apoptose cellulaire. La conception de matériaux multifonctionnels capables à la fois de délivrer sélectivement un médicament dans les cellules de manière ciblée et d’afficher une propension accrue à la biodégradation est un pas en avant dans le développement d’applications biomédicales des matériaux 2D.
- Ali-Boucetta, H. et al. (2013) Angew. Chem. Int. Ed. 52, 2274-2278.
- Al-Jamal, K. T. et al. (2012) Angew. Chem. Int. Ed. 51, 6389-6393. b) Murphy, F. A. et al. (2011) Am. J. Pathol. 178, 2587-2600.
- Ali-Boucetta, H. et al. (2011) Small 7, 3230-3238. b) Lacerda, L. et al. (2012) Biomaterials 33, 3334-3343. c) Kraszewski, S. et al. (2012) PloS One e40703. d) Wang, J. T.-W. et al. (2016) J. Control Rel. 224, 22-32.
- Delogu, L. G. et al. (2012) Nanomedicine 7, 231-243.
- Bianco A. (2013) Angew. Chem. Int. Ed. 52, 4986-4997. b) Wick, P. et al. (2014) Angew. Chem. Int. Ed. 53, 7714-7718. c) Fadeel, B. et al. (2018), ACS Nano 12, 10582-10620.
- Russier, J. et al. (2013) Nanoscale 5, 11234-11247.
- Orecchioni, M. et al. (2016) Adv. Healthc. Mater. DOI: DOI: 10.1002/adhm.201500606
- Jasim, D. A. et al. (2015) Chem. Sci. 6, 3952-3964. b) Jasim, D. A. at al. (2016) ACS Nano 10, 10753-10767.
- Orecchioni et al. (2017) Nat. Commun. 8, 1109.
- Lin, H. et al. (2020) Small 35, 2002194.
- Ruiz A. et al. (2020) Carbon 170, 347-360.
- Russier, J. et al. (2011) Nanoscale 3, 893-896.
- Elgrabli, D. et al. (2015) ACS Nano 9, 10113-10124.
- Sureshbabu, A. R. et al. (2015) Biomaterials 72, 20-28.
- Ma, B. et al. (2020) Chem. Soc. Rev. 49, 6224-6247.
- Kurapati, R. et al. (2015) Small 11, 3985-3994.
- Kurapati, R. et al. (2018) Angew. Chem. Int. Ed. 57, 11722-11727.
- a) Kurapati, R. et al. (2016) Angew. Chem. Int. Ed. 55, 5506-5511. b) Kurapati, R. et al. (2017) Adv. Funct. Mater. 27, 1605176.
- Kurapati, R. et al. (2018) 2D Mater. 5, 015020.
- Martín, C. et al. (2019) Adv. Funct. Mater. 29, 1901761.
 Intranet
Intranet Acces
Acces Contact
Contact
