Applications biomédicales de nanomatériaux carbonés et 2D fonctionnalisés
Nous avons exploité différents types de NTC fonctionnalisés pour le ciblage, la délivrance de médicaments et la désactivation (silencing) de gènes. En particulier, nous avons exploré diverses stratégies pour la conjugaison d’anticorps aux NTC, par amidation ou réaction thiol-ène, afin de cibler les cellules cancéreuses (1). Nous avons démontré que les NTC conjugués à l’anticorps Cetuximab étaient capables de cibler le récepteur du facteur de croissance épidermique, surexprimé par de nombreuses cellules cancéreuses (1). Nous avons également fonctionnalisé les NTC avec un peptide de ciblage mitochondrial et observé la localisation des nanotubes dans ces organites (2). Le ciblage des mitochondries pourrait ouvrir la voie à la mise au point de systèmes alternatifs de lutte contre les maladies liées aux mutations génétiques dans l’ADN mitochondrial, en délivrant des oligonucléotides thérapeutiques. Nous avons également décrit la dérivatisation covalente contrôlée par de NTC tri-fonctionnalisés avec un médicament anticancéreux, la gemcitabine, l’acide folique en tant que ligand de ciblage des cellules cancéreuses et la fluorescéine pour l’imagerie (3). Nous avonsmontré que l’activité anticancéreuse de la gemcitabine a été maintenue après greffage covalent sur les NTC. Néanmoins, les nanotubes fonctionnalisés ont été internalisés à la fois dans des cellules folate-positives et négatives, suggérant la diffusion passive des NTC à travers la membrane plasmique. Nous avons étudié la biodistribution in vivo de médicaments à base de platine encapsulés dans des NTC à parois multiples (4) et nous avons montré que la cinétique de libération du médicament dépend du diamètre du nanotube (5). En effet, des NTC avec un petit diamètre permettent une libération plus lente du médicament à l’intérieur des cellules tumorales par rapport à des NTC de plus grand diamètre. Nous avons également conçu des NTC cationiques comme vecteurs efficaces de siARN pour l’éradication du cancer du poumon par rapport à des liposomes cationiques (6). En outre, nous avons montré la récupération motrice fonctionnelle d’une lésion ischémique cérébrale par désactivation des siARN (7). Dans une autre étude, nous avons décoré la surface des NTC avec des nanoparticules d’oxyde de fer (NP) via différentes stratégies pour conférer des propriétés magnétiques aux nanotubes (8). Les hybrides NP/NTC ont été exploités pour du marquage cellulaire, le suivi de cellules par imagerie par résonance magnétique et pour des manipulations magnétiques. Nous avons étudié l’utilisation de différents types de nanomatériaux carbonés pour l’ablation photothermique de cellules tumorales, par exemple des NTC à parois multiples remplis de NP d’oxyde de fer (9) et de nanohorns de carbone recouverts de NP de magnétite (10). L’association d’une thérapie photothermique (PTT) à une thérapie photodynamique (PDT) a été réalisée à l’aide de NTC conjugués à un photosensibilisateur (11) (Figure 1) ou à des nanohorns de carbone fonctionnalisés par des colorants (12).
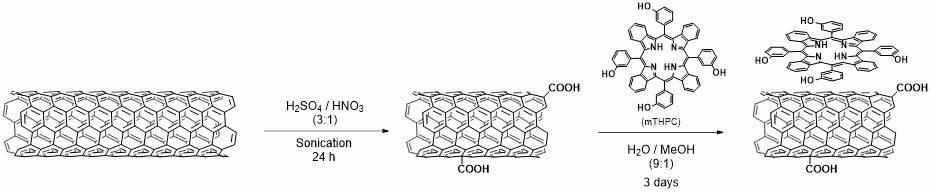
En raison de leurs propriétés uniques, les NTC ont suscité une grande attention pour leurs applications en tant que composants de biomatériaux avancés pour la médecine régénérative. Dans ce contexte, nous avons évalué l’utilisation de NTC fonctionnalisés avec un facteur de croissance de fibroblastes (FGF) comme échafaudages pour la formation osseuse in vitro et in vivo (13). La présence de FGF a permis d’augmenter la prolifération de cellules stromales de la moelle osseuse de rat. Enfin, nous avons mené des études pionnières sur l’utilisation de NTC fonctionnalisés par des groupements amines en tant qu’agents de contraste pour l’échographie (14). Nous avons mené une enquête approfondie pour évaluer les propriétés échogènes des nanotubes, ce qui ouvre des perpectives pour de futures applications en tant que nanoparticules théranostiques, combinant des modalités diagnostiques et thérapeutiques.
Les nanomatériaux de la famille du graphène ont également attiré l’attention d’un nombre croissant de scientifiques pour des applications dans différents domaines. En nanomédecine, le graphène suscite un vif intérêt pour l’administration de médicaments, la biodétection et l’ingénierie tissulaire (15, 16). L’oxyde de graphène (GO), la forme oxydée du graphène, présente un potentiel élevé dans ce domaine. En effet, les groupes fonctionnels oxygénés polaires à sa surface le rendent très hydrophile, conduisant à une bonne dispersibilité dans l’eau. Nous avons développé une nouvelle plate-forme pour la complexation de petites molécules d’ARN interférent (siARN) à l’aide d’échantillons de GO avec divers pourcentages d’oxygène (17). Pour cela, le GO a été fonctionnalisé de manière covalente avec de la triéthylèneglycol diamine et avec de la polyéthylèneimine de faible poids moléculaire (PEI, 800 Da) via une réaction d’ouverture des époxydes. Par gel d’électrophorèse, nous avons pu corréler la capacité de complexation du GO avec la chimie de surface du graphène. Le GO fonctionnalisé avec le PEI a montré une capacité de complexation élevée pour les siRNA, ce qui en fait un candidat prometteur pour le silençage des gènes.
Nous avons également étudié les interactions entre le GO et les molécules de siARN (18). Nous nous sommes concentrés sur la manière dont la taille du GO, les groupes oxygénés présents à la surface et la fonctionnalisation chimique affectent la structure double hélice des siARN. Nous avons observé que la structure secondaire du siARN était clairement altérée par l’interaction avec les feuillets de GO. De plus, nous avons pu corréler les dommages sur la structure double brin avec la taille du GO et les groupes oxygénés présents à sa surface. Enfin, nous avons démontré que le GO fonctionnalisé avec le PEI était capable de protéger les molécules de siRNA de modifications structurelles.
Notre expertise sur la multifonctionnalisation des NTC et du GO permet la conception de conjugués multimodaux pour le traitement de différentes maladies. Nous souhaitons exploiter les propriétés intrinsèques des NTC pour absorber la lumière proche infrarouge et la convertir en chaleur, l’objectif étant de détruire sélectivement les cellules malades ciblées par thérapie photothermique, en combinaison avec d’autres thérapies pour le traitement de maladies auto-immunes et du cancer.
- a) Venturelli, E. et al. (2011) Small 7, 2179-2187. b) Spinato, C. et al. (2016) Nanoscale 8, 12626-12638.
- Battigelli, A. et al. (2013) Nanoscale 5, 9110-9117.
- Ménard-Moyon, C. et al. (2015) Chem. Eur. J. 21, 144886-14482.
- Li, J. et al. (2014) Nanomedicine NMB 10, 1465-1475.
- Muzi, L. et al. (2015) Nanoscale 7, 5383-5394.
- Guo, C. et al. (2015) Bioconjug. Chem. 26, 1370-1379.
- Al-Jamal, K. T. et al. (2011) Proc. Natl Acad. Sci. U. S. A. 108, 10952-10957.
- Lamanna, G., et al. (2013) Nanoscale 5, 4412-4421.
- Liu, X. et al. (2014) ACS Nano 8, 11290-11304.
- Chechetka, S. A. et al. (2015) Chem. Asian J. 10, 160-165.
- Marangon, I. et al. (2016) Carbon 97, 110-123.
- Miyako, E. et al. (2014) Angew. Chem. Int. Ed. Engl. 53, 13121-13125.
- Hirata, E. et al. (2013) Nanotechnology 24, 435101.
- Delogu, L. G. et al. (2012) Proc. Natl Acad. Sci. U. S. A. 109, 16612-16617.
- Kurapati, R. et al. (2016) Adv. Mater. 28, 6052-6074.
- Reina, G. et al. (2017) Chem. Soc. Rev. 46, 4400-4416.
- Chau, N. D. Q. (2017) Carbon 122, 643-652.
- Reina, G. et al. (2018) Nanoscale 10, 5965-5974.
 Intranet
Intranet Acces
Acces Contact
Contact
